自噬、焦亡、铁死亡对动脉粥样硬化调控作用的研究进展
我院活血化瘀与血管重塑研究创新团队聚焦调节性细胞死亡(regulatory cell death,RCD)的常见方式——自噬、焦亡和铁死亡,对相关领域三百余篇文章进行分析和归纳,系统总结了三种RCD形式在动脉粥样硬化中的功能作用和意义,阐述了三者间的相互调控,为动脉粥样硬化的发病机制及治疗方式探寻提供了理论依据。该研究成果发表于Frontiers in Cell and Developmental Biology杂志(影响因子6.684;中科院二区),中医药创新研究院学生蔺琳为第一作者,活血化瘀与血管重塑研究创新团队李运伦教授、张丹教授、李超博士为通讯作者。
动脉粥样硬化是一种脂质驱动的慢性炎症性疾病,以大、中动脉血管壁内斑块逐渐堆积为主要特征,是引起缺血性心脏病和中风的主要原因。血管内皮细胞、平滑肌细胞和巨噬细胞的功能状态、存活和死亡均能影响斑块的形成和稳定,从而影响动脉粥样硬化的进展。RCD是多细胞生物受到各种细胞压力或外部刺激后由基因调控启动的自杀保护措施。适度的RCD有利于循环系统的发育及自我更新,RCD异常往往导致心血管损伤甚至功能失衡。在动脉粥样硬化的病理过程中已发现多种类型的RCD,但针对RCD之间复杂的交互串扰作用的研究及综述较少。
该文章详细总结了自噬、焦亡、铁死亡与动脉粥样硬化中氧化应激、炎症和脂质过氧化的关系,明确了血管细胞自噬、焦亡、铁死亡是动脉粥样硬化的重要发病机制。在动脉粥样硬化病理进程中,过度的氧化应激、炎症反应和脂质过氧化能够诱导血管细胞发生自噬缺陷、焦亡和铁死亡,导致内皮功能障碍、脂质堆积、胶原合成减少、纤维帽变薄、斑块破裂、病变血栓形成等,加重动脉粥样硬化,甚至引起急性冠脉事件。自噬是一种进化保守的稳态机制,研究发现,自噬能通过抑制氧化应激、炎性小体激活及脂质沉积等途径抑制细胞焦亡(图1),从而抑制动脉粥样硬化。此外,自噬对铁死亡也具有调控作用(图2),尽管最近有实验研究表明激活自噬可以抑制泡沫细胞铁死亡,但更多的研究证实了自噬通过多种途径诱导铁死亡,但这些自噬调控机制在动脉粥样硬化血管细胞铁死亡中的作用尚不完全清楚。因此,需要更多的研究来探讨自噬与铁死亡在动脉粥样硬化中的确切关系及相互作用。
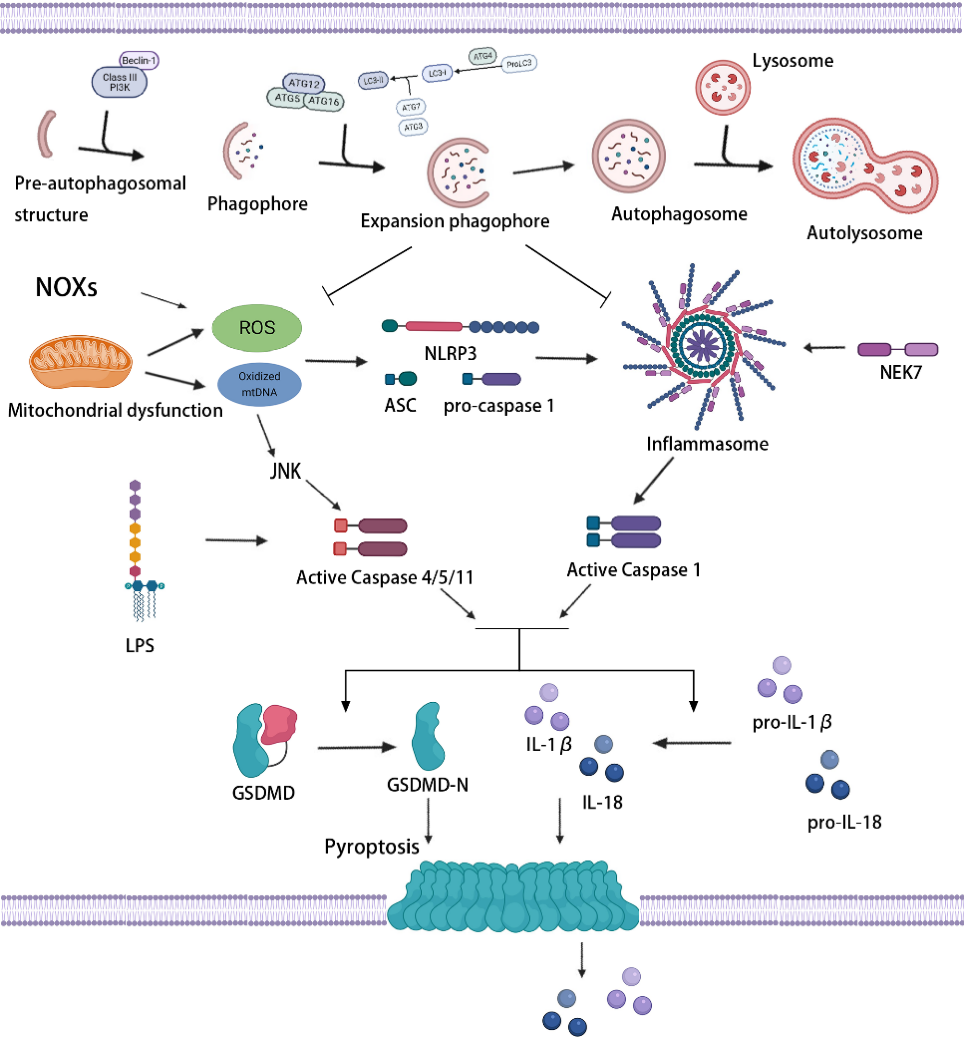
图1自噬与焦亡的调控关系示意图
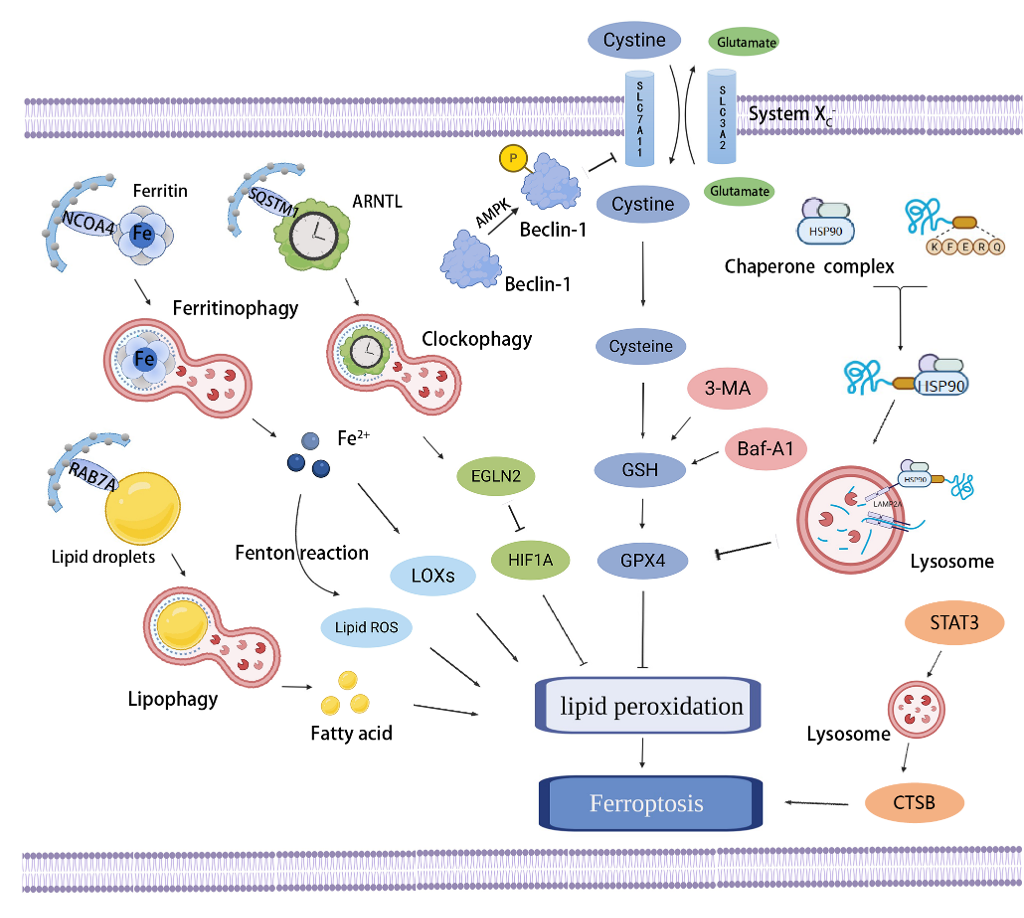
图2自噬与铁死亡的调控关系示意图
原文链接:Lin Lin, Zhang Muxin, Zhang Lei, Zhang Dan, Li Chao, Li Yunlun. Autophagy, Pyroptosis, and Ferroptosis: New Regulatory Mechanisms for Atherosclerosis. Front Cell Dev Biol. 2022 Jan 13;9:809955. doi: 10.3389/fcell.2021.809955. PMID: 35096837; PMCID: PMC8793783.